Teststopp bei Corona-Impfung: "Eigentlich ein positives Signal"
Der Stopp der Impfstoff-Studie des anglo-schwedischen Pharmakonzerns AstraZeneca und der britischen Universität Oxford hat zahlreiche internationale Reaktionen von Experten nach sich gezogen. "Er zeigt, dass der Evaluationsprozess funktioniert und wir diese Phase-3-Studien benötigen", schreibt etwa der in New York tätige österreichische Virologe Florian Krammer auf dem Kurznachrichtendienst Twitter. "Sicherheit vor Schnelligkeit", formuliert es die Frankfurter Virologin Sandra Ciesek knapp.
Bei einem Probanden kam es zu Gesundheitsproblemen, die New York Times schrieb von einer Rückenmarksentzündung – bestätigt ist das allerdings bisher nicht.
Als richtigen Schritt sieht die Impfspezialistin Ursula Wiedermann-Schmidt, Leiterin des Instituts für Spezifische Prophylaxe und Tropenmedizin der MedUni Wien, den Studienstopp: "Es gibt ein Regelwerk, an das sich alle halten müssen. Niemand kann sagen, egal, wir machen trotzdem weiter", sagt sie zum KURIER. "Deswegen kann man auch nicht spekulieren oder versprechen, wann ein Impfstoff verfügbar ist, solange es keine Zulassung gibt. Am Weg zur Zulassung kann immer etwas passieren."
Der Impfstoff von AstraZeneca wird derzeit in Brasilien, Südafrika, den USA, England und Indien getestet. Insgesamt sollen 30.000 Probanden in die Phase-3-Studie – die letzte und größte vor einer Zulassung – eingeschlossen werden. Rund 15.000 Probanden sollen den Wirkstoff schon erhalten haben.
"Wir haben von Anfang an gesagt, dass die Phase 3 die wichtigste Studienphase ist, weil bei dieser der Impfstoff an einer großen Zahl von Probanden getestet wird", betont Wiedermann-Schmidt. Ein unabhängiges "Safety Board", ein Expertengremium, das die Studie begleitet, werde nun prüfen, ob die Gesundheitsprobleme des Studienteilnehmers auf die Impfung zurückzuführen sind "oder ob es keinen Zusammenhang gibt, weil zum Beispiel Grunderkrankungen die Ursache für die Symptome sind".
Danach werde entschieden, ob die Studie in ihrer bestehenden Form weitergeführt werden kann oder Änderungen im Studienablauf notwendig sind – möglicherweise auch an der Formulierung und der Zusammensetzung des Impfstoffes. Im schlimmsten Fall könne es zu einem Abbruch einer Studie kommen. "Das muss abgewartet werden. Spekulationen, was wirklich die Ursache der Gesundheitsprobleme war und wie es weitergeht, sind zum derzeitigen Zeitpunkt nicht möglich."
Deshalb sei diese Pause so wichtig: "Mich beruhigt es zu sehen, dass alles regelkonform abläuft", betont Wiedermann-Schmidt. Der Stopp sei ein Zeichen dafür, dass nicht – wie von vielen Wissenschaftern befürchtet – unter politischem Druck die Studien vorangetrieben werden.
Sie selbst habe sich immer dagegen verwehrt, zu prognostizieren, wann es einen Impfstoff geben kann: "Man muss sich die Zeit nehmen, diese Studienphasen abzuwarten." Und Wiedermann-Schmidt betont, dass auch nach einer ersten temporären Zulassung noch weitere Untersuchungen gemacht und möglicherweise auftretende Nebenwirkungen gemeldet werden müssen. "Es sind in dem Zulassungsverfahren einfach viele Schritte eingebaut, die die Sicherheit eines Impfstoffes gewährleisten sollen."
"Ein positives Signal"
"Wir haben derzeit noch sehr wenige detaillierte Informationen zu dem Fall", schickt Markus Zeitlinger, Leiter der Universitätsklinik für Klinische Pharmakologie der MedUni Wien/AKH Wien, voraus. Man könne allerdings von anderen Arzneimittelstudien auf den groben Hintergrund der Geschehnisse schließen. "Bei klinischen Studien wird immer dann ein zeitweiliger Stopp verhängt, wenn schwerwiegende Nebenwirkungen auftreten, bei denen man nicht vollkommen ausschließen kann, dass sie – zum Beispiel – mit einem getesteten Impfstoff zu tun haben."
Diese Vorgehensweise sei normal und komme auch des Öfteren vor. "Derzeit wurde rund 15.000 Probanden der besagte Oxford-Impfstoff verabreicht, zu milden Nebeneffekten wird es wohl in mehreren Fällen gekommen sein, diese werden dokumentiert, führen aber noch nicht zu einer Pausierung. Wenn massive Nebenwirkungen auftreten – was darunter fällt ist genau klassifiziert –, bei denen ein Konnex mit dem Wirkstoff nicht ausgeschlossen werden kann, muss genau eruiert werden, wodurch diese ausgelöst wurden", sagt Zeitlinger.
Es müsse im konkreten Fall erst belegt werden, dass die Nebenwirkung mit der Impfung zu tun hat. Es könne diverse Gründe gebe, warum der besagte Teilnehmer auf diese Art und Weise aus der Masse heraussticht. "Man muss sich in Ruhe ansehen, warum es gerade diesen einen Probanden getroffen hat. Eventuell leidet er an einer bestimmten Vorerkrankung, die damit in Zusammenhang stehen könnte, oder nimmt spezielle Medikamente ein, die die Nebenwirkung nach Gabe der Impfung mitbedingt haben. Wenn es tatsächlich mit der Impfung in Verbindung steht, kann man daraus lernen."
Wie lange diese Prüfung dauern wird, sei "unmöglich vorherzusagen". Zeitlinger schließt nicht aus, dass es auch bei den neun anderen, derzeit in finalen Testphase befindlichen Präparaten zu einem zwischenzeitlichen Stopp kommen könnte. "Für mich sind die Vorfälle eigentlich ein positives Signal, was die Impfstoffentwicklung betrifft. Sie zeigen, dass selbst bei hektischer Entwicklung unter Zeitdruck Sicherheitsstandards höchst ernst genommen werden."
Wie der Impfstoff wirkt
Bei dem Impfstoff von AstraZeneca handelt es sich um einen Vektorimpfstoff. Harmlose, abgeschwächte Viren (in diesem Fall ein abgeschwächtes Schnupfenvirus von Schimpansen), die im Menschen keine Erkrankung auslösen, werden so verändert, dass sie charakteristische Oberflächenbestandteile des Coronavirus aufweisen. Dem Immunsystem wird so eine SARS-CoV-2-Infektion vorgegaukelt – das Immunsystem reagiert und bildet Antikörper.
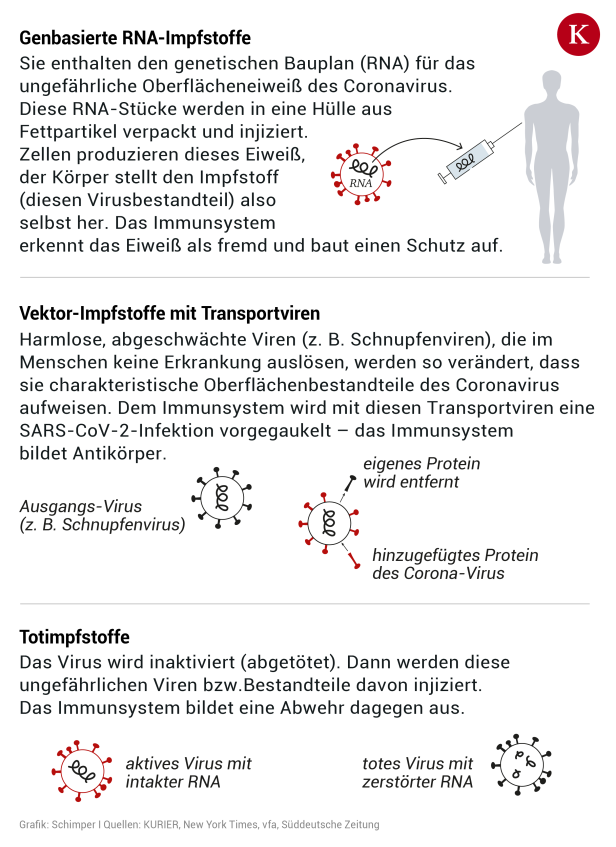
Allerdings kann es bei dieser Art von Impfstoffen dazu kommen, dass das Immunsystem auch auf das Trägervirus, das abgeschwächte Schnupfenvirus, selbst reagiert. "Diese Impfstoffe haben in einigen Fällen das Problem, dass eine Immunreaktion gegen das Vektor-Virus vorliegt oder hervorgerufen wird", sagt der deutsche Virologe Stephan Becker der Süddeutschen Zeitung. Durch die Verwendung eines Schimpansenvirus versucht man dieses Risiko zu minimieren.
Was die kursierende Diagnose bedeutet
Die New York Times schreibt, dass der erkrankte Proband von einer "transversen Myelitis" betroffen sei. "Eine transverse Myelitis ist eine Entzündung des Rückenmarks. Sie kann als Folge einer Infektion auftreten und wird meist durch Viren – also theoretisch auch durch SARS-CoV-2 – ausgelöst", sagt Thomas Berger, Leiter der Abteilung für Neurologie, MedUni Wien. Aus anderen Ländern kennt man auch eine durch Parasiten, Bakterien oder Würmer ausgelöste Infektion. Ein möglicher Mechanismus dabei: Das Immunsystem erkennt eine Sequenz, einen Baustein, aus dem Virus, etwa eine Aminosäuresequenz. Diese kommt aber zufällig auch natürlicherweise im Körper, etwa im Rückenmark, vor. Das Immunsystem richtet sich gegen diese Sequenz – und damit nicht nur gegen das Virus, sondern auch gegen den eigenen Körper.
Eine weitere Möglichkeit für das Auftreten dieser Rückenmarksentzündung: "Sie kann auch als direkte Reaktion auf eine Impfung – also postvakzinal - auftreten", sagt Berger. In einem solchen Fall sei klar, dass es sich um eine Nebenwirkung der Impfung handelt. "Das kennen wir von anderen Impfungen. Diese Nebenwirkungen sind aber so selten, dass es keinesfalls generell gegen Impfungen spricht", betont der Experte. Statistisch kommt es bei einer Million Impfungen zu einem derartigen Fall. Da das Phänomen bekannt sei, sei es "nicht ganz unplausibel", dass es auch bei einer Impfung gegen SARS-CoV-2 auftreten könnte.
Im Fall der nun vorläufig gestoppten AstraZeneca-Studie ist allerdings noch einiges unklar. So gibt es etwa vom Pharmaunternehmen noch keine offizielle Stellungnahme, dass es sich bei der aufgetretenen Nebenwirkung tatsächlich um transverse Myelitis handelt.

"Nicht der Regelfall"
Dass es zu einer derartigen fehlgeleiteten Kreuzreaktion nach einer Impfung kommt, sei auch laut Peter Dal-Bianco, Facharzt für Neurologie, grundsätzlich denkbar. "Durch die Impfung wird das Immunsystem aktiviert und kann so auch gegen körpereigene Strukturen vorgehen. Das ist nicht der Regelfall, aber es ist möglich."
Die folglich auftretenden Beschwerden hängen dem Experten zufolge davon ab, wo die Entzündung stattfindet. Betriff sie wie bei der transversen Myelitis das Rückenmark, kann es zu sensomotorischen Störungen (betreffen Geschicklichkeit, Bewegungsqualität und Tempo, Körperhaltung und Koordination), aber auch zu Störungen des vegetativen Nervensystems kommen, etwa zu einer Überlaufblase oder Inkontinenz. "Das Myelon ist jener Strang, durch den Botschaften vom Hirn in die Peripherie des Körpers laufen und auch die Rückmeldungen aus der Peripherie an das Hirn rückgeleitet werden", sagt er.
Behandelt werde die Erkrankung mit entzündungshemmenden Cortison. "Sofern kein Erreger im Spiel ist, reicht das aus." Bleibende Schäden seien aber nicht ausgeschlossen.
Firmen wollen "keine Kompromisse"
Unterdessen haben neun in der Impfstoff-Forschung führende Pharmaunternehmen eine gemeinsame Stellungnahme veröffentlicht: Bei der Entwicklung der Impfstoffe werde man keine Kompromisse eingehen. Die Zulassung werde erst dann beantragt, wenn Verträglichkeit und Wirksamkeit ausreichend mit einer "rigorosen klinischen Studie der Phase drei" belegt sind. Dies gelte auch für eine mögliche Notfallgenehmigung. Die unterzeichnenden Firmen sind AstraZeneca, BioNTech, GlaxoSmithKline, Johnson&Johnson, Merck, Moderna, Novavax, Pfizer und Sanofi.


Kommentare