Corona-Impfstoffe: Die Welt als Versuchslabor

Finale Impftests zeigen teils erste verheißungsvolle Ergebnisse.
Es klang wie eine Nachricht für Medizin-Insider: "Chinesische Virologen entschlüsseln genetischen Code des neuartigen Virus" titelten Nachrichtenagenturen am 21. Jänner. Schon damals fiel der Startschuss für die Entwicklung einer Vakzine gegen den pandemischen Erreger. Aktuell listet die Weltgesundheitsorganisation (WHO) über 160 Corona-Impfstoffprojekte, jedes umfasst Labortests, Tierversuche, die Erprobung am Menschen in drei Phasen, die Zulassung durch die zuständige Arzneimittelbehörde sowie die Eingliederung in nationale Impfprogramme.
Herzstück der Impfstoffentwicklung sind Tests an Zehntausenden Freiwilligen (Phase III), um die Verträglichkeit zu prüfen und problematische Nebenwirkungen auszuschließen. "Vorrangig geht es aber darum, zu untersuchen, ob die Impfung unter realen Bedingungen funktioniert und den Menschen wirklich schützt", sagt Gerald Gartlehner, klinischer Epidemiologe und Leiter des Departments für Evidenzbasierte Medizin und Evaluation an der Donau-Universität Krems.
Das sei etwa in Russland, wo vergangene Woche der erste Corona-Impfstoff zugelassen wurde, nicht passiert. In anderen Ländern geschieht das sehr wohl – groß angelegt unter anderem in China, den USA, Südafrika und Australien, in kleinerem Stil in Italien und Deutschland. Nirgendwo sonst laufen so viele Impfstoffversuche wie in Brasilien. Der Hauptgrund ist naheliegend: "Wenn man die Effektivität prüfen will, muss man in Länder mit hohen Infektionszahlen", sagt Infektiologe und Impfstoff-Experte Herwig Kollaritsch. Je Corona-gebeutelter ein Land, desto schneller lasse sich ablesen, ob ein Impfstoff zuverlässig schützt. In Österreich wäre das ein Ding der Unmöglichkeit, beschreibt Gartlehner: "Man bräuchte eine immens große Stichprobe für zuverlässige Ergebnisse."
Ebenso ist von Vorteil, wenn ein Land seuchenerprobt ist, bereits groß angelegte Impfkampagnen durchgeführt hat und über eine Infrastruktur verfügt, um den logistischen Anforderungen solcher Impfgroßeinsätze gerecht zu werden. All diese Kriterien erfüllt Brasilien, wo mit Impfkampagnen Krankheiten wie Tuberkulose oder Gelbfieber kleingehalten wurden. Auch Südafrika hat Erfahrung mit klinischen, nach internationalen Standards abgewickelten Studien – von Ethikkomitees kontrolliert.
Ethische Bedenken
Stichwort Ethik. Dass es Kritiker gibt, die angesichts großer Testreihen in sozioökonomisch benachteiligten Ländern Verdächtiges vermuten, kann Kollaritsch nachvollziehen. "Impfstudien müssen aber einerseits multinational, also in verschiedenen Ländern, durchgeführt werden, damit bestätigt wird, dass ein Produkt in unterschiedlichen Bevölkerungsgruppen wirkt – und sind anderseits wahnsinnig teuer. Man sollte ehrlicherweise anerkennen, dass diese Kosten steigen, je entwickelter ein Land ist. Man muss aber auch verstehen, dass solche Studien immer nach dem gleichen, strengen Schema ablaufen." Das Design werde einer Ethikkommission vorgelegt, die es absegnen muss. Erst dann dürfen Freiwillige rekrutiert werden. "Ich kann mir nur schwer vorstellen, dass in Brasilien oder Südafrika solche Standards umgangen werden", sagt Kollaritsch.
Beurteilend beäugt werde auch von außen: "Es gibt exakte Regelwerke bei der Prüfung, wie auch bei der Herstellung. Die Zulassungsbehörden kontrollieren genau." Wer in der klinischen Phase patzt oder unscharf agiert, riskiere später, von Zulassungsbehörden wegen Unstimmigkeiten abgelehnt zu werden.
In Brasilien kann man sich auf der Website des brasilianischen Forschungszentrums Instituto Butantan unter Angabe relevanter Daten für Corona-Impfstofftests anmelden. Die Richtlinien für klinische Studien umfassen auch, dass Probanden ausführlich aufgeklärt werden und Einverständnisdokumente unterschreiben. Geringe Aufwandsentschädigungen sind durchaus üblich, wirklich Geld verdienen lässt sich damit aber nicht. Probanden können die Teilnahme ohne Angabe von Gründen beenden.
Ganz uneigennützig handeln Länder wie Brasilien übrigens nicht: Wer großen Impfstudien den Weg ebnet, sichert sich einen schnellen Zugang zu einem zugelassenen Präparat.
Das Risiko für Probanden in der finalen Erprobungsphase III sei zum jetzigen Zeitpunkt laut Gartlehner überschaubar: "Es ist jedenfalls lobenswert, dass sich diese Menschen in den Dienst der Wissenschaft stellen." Man könne nur hoffen, dass ein Großteil der finalen Tests von Erfolg gekrönt ist.
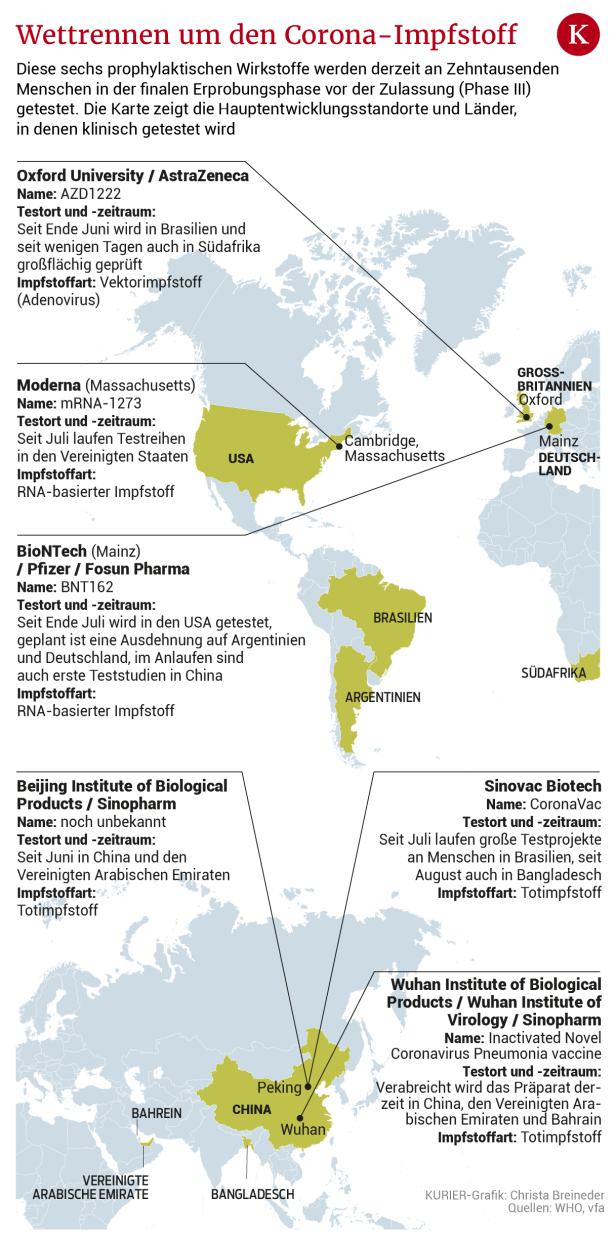
Status quo
Bisher haben die meisten Impfstoff-Kandidaten in der finalen Testung – es sind aktuell sechs an der Zahl – teils erste verheißungsvolle Ergebnisse sowie milde Nebenwirkungen wie Fieber und/oder Schmerzen an der Einstichstelle hervorgebracht. Werden das – angesichts der Lage – zu tolerierende Nebeneffekte bleiben? "Das sind normale Impfreaktionen. Nichts Außergewöhnliches", betont Kollaritsch. "Solange sie in einem erträglichen Prozentsatz und in geringer Intensität auftreten, muss man sich keine Gedanken machen." Vielmehr müsse man sich vor Augen halten, dass "Medikamente ohne Nebenwirkung auch keine Hauptwirkung haben. Der Nutzen muss aber das Risiko überwiegen, das ist klar."
Angesichts der unbedingt einzuhaltenden Sicherheitsstandards werde es laut Gartlehner vor dem Sommer/Herbst 2021 dennoch keine marktzulässige Impfung geben.
Welcher Impfstoff auch immer die umfangreichen Tests zuerst erfolgreich absolviert, steht dann erst vor einem Zulassungsverfahren. In der EU übernimmt das die Europäische Arzneimittel-Agentur (EMA) – wohl per beschleunigtem Prozedere, sind sich Kollaritsch und Gartlehner sicher. Das bedeute nicht, dass die entsprechende Impfung von der EMA durchgewunken wird. Kollaritsch: "Immerhin trägt sie die Verantwortung für etwaige Folgen."
Der Klassiker
Totimpfstoffe wurden schon vor Jahrzehnten in der Impfstoffentwicklung genutzt, die Technologie seither verfeinert. Das Kernkonzept blieb unverändert: Man verwendet Schlüsselantigene eines Erregers, also Proteine, die eine schützende Immunantwort auslösen. Diese stellt man üblicherweise in Hefezellen her und ergänzt sie durch Hilfsstoffe, die ihre Wirkung verstärken. Impfungen nach diesem Schema existieren etwa gegen Hepatitis B oder HPV. Vorteil: Die Technologie funktioniert und ist erprobt. Nachteil: Die Dosisfindung ist kompliziert, man muss nachimpfen.
Der Listige
Für Vektorimpfstoffe verwendet man einen Erreger, der für den Menschen harmlos ist. Dieser wird genetisch so verändert, dass er zum einen nicht mehr vermehrungsfähig ist (sich im Körper nicht hemmungslos ausbreiten kann) und zum anderen dem krankmachenden Virus, gegen den man immunisieren will, oberflächlich gleicht. Der so entstandene Vektor wird vom menschlichen Immunsystem als bösartiger Erreger verkannt, er bildet Abwehrstoffe, der Mensch bleibt aber gesund. Vorteil: Auch hier gibt es bestehende Impfstoffe, die nach diesem Prinzip funktionieren, etwa die neue Ebola-Impfung. Nachteil: Gegen den Vektor kann Immunität aufgebaut werden, man kann ihn dann nicht mehrmals verabreichen.
Der Neumoderne
Bei RNA-basierten Impfstoffen (Ribonukleinsäure, englisch RNA für „ribonucleic acid“) bekommt der Organismus den Bauplan eines Impfstoffes verabreicht. Der Körper erhält die Anleitung für ein Protein der Hülle des Coronavirus. Dafür wird genetisches Material (RNA-Stücke des Virus) verwendet, das in den Zellen abgelesen wird. Diese bilden Antigene, die die Immunabwehr stimulieren. Nach einer Impfung bilden die menschlichen Zellen dieses Protein. Der Körper erkennt es als fremd und beginnt, Antikörper sowie Abwehrstoffe dagegen zu bilden. Nachteil: Die Impfungen sind oft weniger gut verträglich. Das ist der Preis für den großen Vorteil: die sehr gute lang anhaltende Immunantwort. Der Haken: Es gibt noch keinen RNA-basierten Impfstoff, der zugelassen wurde. Es muss im Falle von SARS-CoV-2 nicht nur die Impfung an sich, sondern auch die Technologie zugelassen werden.

Kommentare