Coronavirus-Impfstoff: "Die beste Nachricht seit Monaten"
Pfizer und Partner Biontech könnten damit die weltweit ersten Unternehmen sein, die erfolgreiche Daten aus der für eine Zulassung entscheidenden Studienphase vorlegen können.
Auch wenn freilich noch längst nicht alles geklärt ist: Die Veröffentlichung erster Daten, wonach der Coronavirus-Impfstoff des deutschen Unternehmens BioNTech und des US-Pharmakonzerns Pfizer einen mehr als 90-prozentigen Schutz vor der Krankheit Covid-19 bieten soll, wird von Spezialisten durchwegs als positiv bis sensationell aufgenommen. "Das ist der erste Beleg, dass Covid-19 durch einen Impfstoff beim Menschen verhindert werden kann", sagte BioNTech-Chef Ugur Sahin gegenüber Reuters. "Das ist die beste Meldung seit Monaten", ist auch Markus Zeitlinger, Leiter der Abteilung für klinische Pharmakologie der MedUni Wien, sehr optimistisch.
Gleichzeitig betonen sie aber auch, dass es sich um vorläufige Daten handelt, die noch nicht wissenschaftlich in einem Fachjournal publiziert wurden.
Was konnte genau gezeigt werden?
44.000 Probanden nehmen an der Zulassungsstudie teil, mehr als 43.500 haben bisher mindestens eine der beiden Teilimpfungen erhalten. Diese werden im Abstand von drei Wochen verabreicht. Eine Hälfte der Testpersonen bekam zwei Dosen des tatsächlichen Impfstoffes, die andere ein wirkungsloses Scheinpräparat (Placebo). Bis Sonntag wurden unter allen Teilnehmern 94 Erkrankungsfälle bestätigt. Für jene Studienteilnehmer, die den Impfstoff erhielten, war das Risiko, an Covid-19 zu erkranken, um mehr als 90 Prozent geringer als für jene, die nur das Placebo erhielten. Das bedeutet: In der Impfstoffgruppe kann es maximal neun (oder weniger) der 94 Erkrankungsfälle gegeben haben.
Wie kann man diese Schutzwirkung von 90 Prozent einstufen?
Als sehr hoch. Grippe-Impfstoffe liegen mit maximal 70 Prozent deutlich darunter. Die US-Zulassungsbehörde FDA hatte einen 50-prozentigen Schutz als Schwelle für eine Zulassung genannt. Allerdings weiß man nicht, ob auch bei Menschen über 65 oder generell Risikopersonen, die von der Studie nicht untersucht wurden, der Schutz genauso hoch ist.
Wie sah es mit Nebenwirkungen aus?
Es wurden bisher laut Unternehmensangaben keine schwerwiegenden Nebenwirkungen gemeldet. "Das ist besonders beeindruckend und ein Meilenstein", sagt Impfspezialist Herwig Kollaritsch. "Es gab ja Bedenken, dass diese neue Impfstoffart sehr gut wirksam, aber schlecht verträglich sein könnte. Das scheint aber nicht der Fall zu sein."
Fachleute reagieren durchwegs mit Zuversicht auf die ersten, vorläufigen Erkenntnisse zu dem Impfstoffkandidaten:
Florian Krammer, Ican School of Medicine in New York: "Das ist die beste Nachricht seit Beginn der Pandemie."
Markus Zeitlinger, klinischer Pharmakologe, MedUni Wien: "Auch wenn es noch offene Fragen gibt, muss man ganz eindeutig die positive Nachricht in den Vordergrund stellen. Das Zwischenergebnis, das jetzt veröffentlicht wurde, ist wesentlich mehr, als für eine Zulassung die Voraussetzung gewesen wäre. Natürlich müssen wir noch auf weitere Daten warten, aber wir können zuversichtlich sein."
Herwig Kollaritsch, Infektionsspezialist: "90 Prozent Wirksamkeit wäre eine tolle Geschichte. Das ist ein Meilenstein. Man sollte nicht zu euphorisch sein, darf es aber auch nicht unterbewerten. Es ist ein sehr schönes Ergebnis. Denn die Daten zeigen, dass es die Möglichkeit gibt, einen Impfstoff herzustellen, der auch wirklich wirksam ist – es ist sozusagen gezeigt worden, dass das Prinzip funktioniert. Jetzt geht es darum zu schauen, was er unter welchen Bedingungen auch tatsächlich kann."
Peter Horby, Infektiologe der Uni Oxford: "Diese Nachricht hat bei mir ein breites Lächeln provoziert. Es ist eine Erleichterung, solch positive Ergebnisse bei diesem Impfstoff zu sehen, und es ist ein gutes Zeichen für Covid-19-Impfstoffe im Allgemeinen. Natürlich müssen wir uns mehr Details ansehen und auf die endgültigen Ergebnisse warten, und es ist noch ein langer, langer Weg, bis Impfstoffe einen echten Effekt haben werden, aber das fühlt sich für mich wie ein Wendepunkt an."
Gerd Fätkenheuer, Infektiologe, Uni Köln: "Ich denke, das wird unseren Umgang mit der Pandemie entscheidend beeinflussen, und ich hoffe, dass rasch große Mengen des Impfstoffes zur Verfügung stehen werden."
Kathrin Jansen, Leiterin der Impfstoffforschung bei Pfizer: "Das ist ein historischer Moment – wir haben etwas erreicht, was noch niemand erreicht hat – einen Impfstoff innerhalb eines Jahres zu produzieren."
Albert Bourla, CEO Pfizer: "Ein großartiger Tag für Wissenschaft und Menschheit. Die ersten Ergebnisse unserer Phase-3-Impfstoffstudie liefern den ersten Beweis, dass es möglich ist, Covid-19 zu verhindern."
Verhindert der Impfstoff auch, dass Infektionen weitergegeben werden?
Das ist bis jetzt nicht untersucht, betonen Experten. Das heißt: Er könnte zwar dem Geimpften helfen, in dem dieser nicht oder nur milder erkrankt. Ob das bedeutet, dass eine Infektion nicht an andere weitergegeben werden kann, ist noch unklar.

Weiß man schon, wie lange der Schutz anhalten wird?
Belegt ist bisher, dass der hohe Schutz zumindest über einen Zeitraum von drei Wochen anhält. "Wahrscheinlich wird er auch länger andauern, aber diese Daten gibt es noch nicht", betont Zeitlinger.
Wie aufwendig ist die Herstellung?
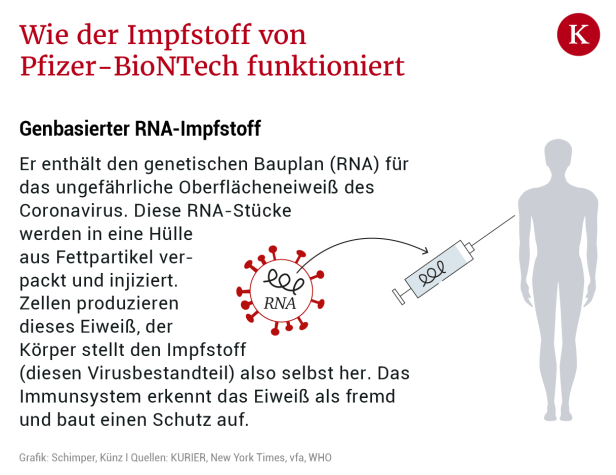
"Diese Impfstoffe sind relativ leicht zu produzieren", sagt Kollaritsch. Der neuartige RNA-Impfstoff (siehe Grafik) – weltweit ist noch keiner dieser Klasse zugelassen – enthält lediglich genetische Informationen des Erregers, aus denen der Körper dann ein Viruseiweiß herstellt, das vom Immunsystem bekämpft wird. "Sie brauchen also zur Herstellung kein Virus, das geht alles vollsynthetisch", sagt Kollaritsch. Ein größeres Problem könnte die Lagerung sein, die bei rund minus 70 Grad notwendig sein wird. Zeitlinger: "Es wird also nicht der Hausarzt impfen können. Impfungen werden nur in Zentren mit speziellen Kühlschränken möglich sein."
Warten auf mehr Daten
Bis Ende des Monats wollen Pfizer/BioNTech mit dem Antrag auf Zulassung in den USA noch warten – dann liegen auch Sicherheitsdaten für einen Zeitraum von zwei Monaten vor
Antrag noch heuer
Seit Ende September/Anfang Oktober begutachtet auch die Europäische Arzneimittelbehörde EMA bereits diesen und einen weiteren Coronavirus-Impfstoff (von AstraZeneca und der Uni Oxford). Die EMA entscheidet erst, wenn sie genug Daten hat, ob eine Firma einen Antrag auf Zulassung stellen kann
Dass dies noch heuer der Fall ist, ist sehr wahrscheinlich geworden. Mit einer Zulassung unter Auflagen könnte es rasch gehen. Bei dem Medikament Remdesivir hat dieser formale Begutachtungsprozess nur noch
20 Tage gedauert
Produktionskapazität
BioNTech und Pfizer rechnen damit, noch in diesem Jahr weltweit bis zu 50 Millionen Impfstoffdosen bereitstellen zu können. Im kommenden Jahr kalkulieren sie mit bis zu 1,3 Milliarden Dosen




Kommentare