Covid-Therapie: Welche neuen Entwicklungen für Zuversicht sorgen
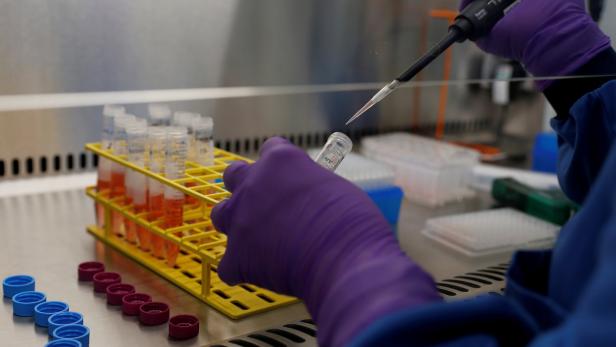
Labor beim Pharmakonzern GSK: Der neue Antikörper Sotrovimab soll auch gegen die Omikron-Variante wirksam sein.
Es ging in den vielen Meldungen über die Omikron-Variante ein wenig unter: Die Europäische Arzneimittelagentur EMA hat sich für die Zulassung des Antikörpermedikaments Xevudy (Sotrovimab) zur Therapie von Covid-19 ausgesprochen. Die offizielle Zulassung in den kommenden Tagen durch die EU ist damit nur noch eine Formsache. Der deutsche Intensivmediziner Christian Karagiannidis hat das auf Twitter als "sehr gute Nachricht" bezeichnet. Gleichzeitig unterstützt die EMA den Einsatz des noch nicht zugelassenen Coronamedikaments Paxlovid für Notfälle. Die wichtigsten Neuentwicklungen im Detail.
Bei Sotrovimab handelt es sich um einen sogenannten monoklonalen Antikörper. Monoklonal bedeutet, dass die im Labor hergestellten Antikörper alle gleich sind. Sie verhindern, dass die Viren an die Körperzellen andocken können. Sie binden an spezielle Stellen am Spike-Protein des Virus, die dieses zum Eindringen in die Zellen benötigt - und blockieren damit das Andocken. Deshalb müssen sie auch in der Frühphase der Erkrankung eingesetzt werden. Zwei solcher Präparate sind bereits zugelassen in der EU: Eines der Firmen Roche und Regeneron (damit wurde im Vorjahr auch Ex-US-Präsident Trump behandelt) und eines von Celltrion.
Das Besondere an Sotrovimab: "Es wirkt nach ersten Ergebnissen (auch – Anm.) gegen Omikron", schreibt Karagiannidis. Dies ist bei vielen anderen Präparaten aus dieser Gruppe nicht oder nur sehr geringfügig der Fall.
Die als Infusion zu verabreichenden monoklonalen Antikörper von GSK und Vir Biotechnology können in der Frühphase der Erkrankung bei Personen ab 12 Jahren eingesetzt werden, die noch keinen zusätzlichen Sauerstoff benötigen und ein erhöhtes Risiko für einen schweren Verlauf haben. In der Zulassungsstudie mussten von 528 Risikopatienten, die Sotrovimab erhielten, nur sechs stationär behandelt werden (1 %), in der Placebo-Gruppe (529 Patienten) waren es 30 (6 %), zwei davon starben.
Die EU hat 220.000 Dosen bestellt. "Über Anforderung durch die Kliniken ist es aber schon seit einigen Wochen in Österreich verfügbar und wurde auch schon eingesetzt", sagt eine GSK-Sprecherin.
Allerdings: Nur bei frühzeitiger Gabe der monoklonalen Antikörper können, insbesondere bei Patientinnen und Patienten, bei denen stationäre Behandlungen zu erwarten sind, schwere Krankheitsverläufe vermieden werden. "Der Einsatz der Antikörpermedikamente bei Krankenhauseinweisung der Patienten kommt oftmals zeitlich zu spät", heißt es im deutschen Ärzteblatt. "Der Beginn der Infusionstherapie (Einmalinfusion in die Vene) sollte – um erfolgreich zu sein – möglichst innerhalb von fünf Tagen nach positivem PCR-Test beziehungsweise sieben Tagen nach Symptombeginn erfolgen."
Medikament zur Covid-Vorbeugung
Positive Nachrichten gibt es auch vom in der EU noch nicht zugelassenen Antikörperpräparat Evusheld von Astra Zeneca. Laut unabhängiger Studie der US-Arzneimittelbehörde FDA soll auch dieses Medikament gegen Omikron wirksam sein. In den USA ist es für die Prophylaxe von Covid-19 zugelassen: Für Menschen mit einem geschwächten Immunsystem, bei denen die Impfung nicht wirkt und die keine Antikörper bilden, oder solche, die aus medizinischen Gründen wie einer starken allergischen Reaktion gegen Inhaltsstoffe der Impfstoffe nicht geimpft werden können. Es ist aber kein Ersatz für die Impfung - das gilt für alle Medikamente.
EMA unterstützt Paxlovid-Einsatz
Als Durchbruch wurde dieser Tage die noch nicht zugelassene Tablette Paxlovid des Pharmakonzerns Pfizer von Experten bezeichnet - der KURIER berichtete. Das Präparat soll bei Risikopatienten einen sehr hohen Schutz vor schweren Covid-Verläufen bieten. Jetzt gab die Europäische Arzneimittelbehörde EMA bekannt, dass sie den Einsatz zur Behandlung von Notfällen unterstützt.
Die Tabletten könnten "zur Behandlung von Erwachsenen mit Covid-19 eingesetzt werden, die keinen zusätzlichen Sauerstoff benötigen und bei denen ein erhöhtes Risiko eines schweren Krankheitsverlaufs besteht", so die EMA. Das bedeutet, dass das Medikament noch vor seiner Zulassung in der EU eingesetzt werden kann - so wie das auch bei Sotrovimab der Fall war. Auch hier gab es eine entsprechende EMA-Empfehlung.

Kommentare