Erste Therapie mit Genschere zugelassen: 6 Fragen und Antworten

Im Erbgut kann es zu Mutationen kommen, die das Krebsrisiko erhöhen.
Die britische Arzneimittelbehörde MHRA hat die erste Therapie auf Basis der Genschere CRISPR/Cas zugelassen. Die Gentherapie mit der Bezeichnung "exa-cel" (Markenname "Casgevy") wirkt gegen die Bluterkrankungen Sichelzellenanämie und Beta-Thalassämie und soll Patientinnen und Patienten vor den schmerzhaften und schwächenden Auswirkungen der beiden Erbkrankheiten befreien.
Es ist das erste Mal, dass ein Land eine Gentherapie auf Basis dieser Technik zulässt. Die amerikanische Arzneimittelbehörde FDA will am 8. Dezember darüber entscheiden, ob die Therapie in den USA zugelassen werden soll. Bei der europäischen EMA läuft noch ein Bewertungsverfahren.
Wie funktioniert die Genschere, welche Folgen kann der Eingriff haben und wer kann profitieren? Der KURIER beantwortet die wichtigsten Fragen.
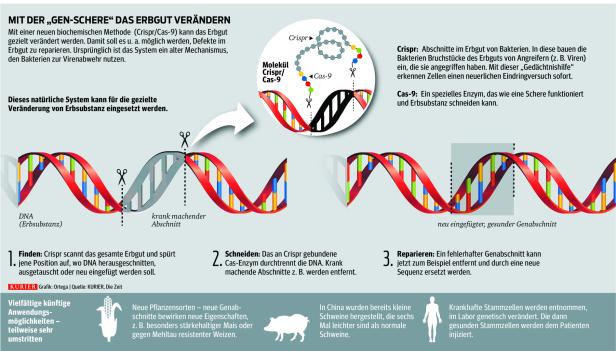
Wie funktioniert die CRISPR/Cas-Technik?
Die Technik ermöglicht, bestimmte Abschnitte aus der DNA zu entfernen und durch neue Gensequenzen zu ersetzen. Sie basiert auf einem Prozess, den Wissenschaftler bei Bakterien beobachteten und weiterentwickelten. CRISPR (kurz für Clustered Regularly Interspaced Short Palindromic Repeats) sind bestimmte Abschnitte auf der DNA von Bakterien, mit denen sie sich gegen Viren wehren. Gemeinsam mit den sogenannten Cas-Proteinen wirken die CRISPR-Sequenzen wie eine Schere, die gezielt virales genetisches Material entfernen kann – das Virus kann sich dann nicht im Bakterium vermehren und weiterverbreiten.
Diese Fähigkeit machten sich Wissenschaftler zunutze und entwickelten eine Art Werkzeug, das bei menschlicher DNA eingesetzt werden kann: die Genschere. Mit ihr können gezielte Veränderungen am Erbgut vorgenommen werden, indem Gene ausgeschaltet werden, defekte durch korrekte DNA-Teile ersetzt oder neue Gensequenzen eingefügt werden. 2020 wurde die Entdeckung der Genschere mit dem Nobelpreis für Chemie ausgezeichnet.
➤ Mehr lesen: Nobelpreis für Chemie geht an Entwicklerinnen der Genschere
Zentral ist, dass nicht die DNA verändert wird, die für die Vererbung wichtig ist. Die Erkrankungen können also auch nach der Gentherapie mit der Genschere, die nun in Großbritannien zugelassen wurde, weiterhin auf die Nachkommen vererbt werden.
Was kostet die Therapie?
Die Herstellung der Zellen ist laut Corbacioglu sehr aufwendig. Noch seien die Laborstrukturen dafür nicht zufriedenstellend ausgebaut. "Zudem ist die Therapie sehr teuer: Mehr als zwei Millionen Euro soll sie pro Patient kosten. Die Stammzelltransplantation liegt bei maximal 300.000 Euro. Dadurch, dass zum Start erst einmal nur eine Firma die Therapie anbieten wird, dürfte sich der Preis so schnell auch nicht verändern", betont der Experte.
Die aktuelle Behandlung ist für Patientinnen und Patienten ab 12 Jahren mit Beta-Thalassämie und Sichelzellenanämie zugelassen.
Wie schätzen die Experten die Zulassung ein?
Selim Corbacioglu geht davon aus, dass die CRISPR-Technologie auf absehbare Zeit nicht die Stammzelltransplantation ersetzen, sondern ergänzen werde. Die Technologie werde künftig noch verfeinert werden.
Joachim Kunz: "Die Gentherapie mittels CRISPR ist trotz ihrer Limitationen hoch willkommen, weil aktuell für nur rund 20 Prozent der Patienten mit Sichelzellkrankheit ein geeigneter Stammzellspender für eine Transplantation zur Verfügung steht. Die Kosten der CRISPR-Therapie werden aber die Anwendung beschränken."
In Deutschland leben laut Kunz geschätzt 3.000 bis 4.000 Patienten mit Sichelzellanämie. Davon kämen aufgrund des Alters etwa 500 bis 1.000 für die CRISPR-Therapie infrage. Damit kämen bei 1,5 bis 2 Millionen Euro pro Patient allein in Deutschland Kosten von ein bis zwei Milliarden Euro auf die Krankenkassen zu. "Dem stehen zwar Einsparungen gegenüber, weil die Patienten nicht mehr wegen der Komplikationen der Sichelzellkrankheit behandelt werden müssten. Diese werden aber auch im günstigen Fall erst nach Jahrzehnten die einmaligen Kosten der Gentherapie aufwiegen", sagt Kunz.
Es werde eine Diskussion darüber geben, welchen Preis die Krankenkassen bereit sind zu zahlen und welche Patienten in Anbetracht der voraussichtlich limitierten Verfügbarkeit mit Priorität behandelt werden.
Wie erfolgt das bei Patientinnen und Patienten am Beispiel der Sichelzellenanämie?
Bei der Sichelzellenanämie verformen sich die roten Blutzellen sichelförmig aufgrund eines Gendefekts. Die Folge sind unter anderem Blutarmut und Durchblutungsstörungen. Bisher konnten die Symptome nur mit Medikamenten und Bluttransfusionen gelindert werden. Diese Behandlungen sind jedoch lebenslang notwendig. Nur mittels Stammzelltransplantation ist eine Heilung möglich, allerdings ist es nicht einfach, einen Spender zu finden und es kann zu Abstoßungsreaktionen kommen.
Hier setzt die neu zugelassene Gentherapie an: Dazu werden Betroffenen zunächst Blutstammzellen entnommen und im Labor wird mittels Genschere CRISPR/Cas gezielt ein Gen zerstört, das die andauernde Produktion der fehlgeformten roten Blutzellen hemmt. Diese veränderten Blutstammzellen werden den Patienten über eine Infusion wieder ins Blut zugeführt. Im Knochenmark werden dann statt der fehlerhaften die veränderten Stammzellen hergestellt. Die Formveränderung der roten Blutkörperchen wird verhindert, der zugrunde liegende Gendefekt umgangen.
➤ Mehr lesen: Erfolg mit der Genschere: Wie er gelang und was Experten sagen
Was sind die Vorteile des Eingriffs?
Selim Corbacioglu, Leiter der Abteilung für Pädiatrische Hämatologie, Onkologie und Stammzelltransplantation, Universitätsklinikum Regensburg, war an der Zulassungsstudie beteiligt und hat den weltweit ersten Patienten mit CRISPR behandelt. Er sagte gegenüber dem deutschen Science Media Center: "Der große Vorteil der CRISPR-Therapie ist, dass es anders als bei der Stammzelltransplantation weder eine Immunreaktion des Körpers (die zu einer Abstoßung führt) noch eine Immunreaktion des Spenders gibt (die sogenannten Graft-versus-Host Erkrankung). Denn es sind ja die eigenen Zellen, die zurück in den Körper kommen. In den aktuellen Studien der Hersteller benötigte ein Großteil der Probanden mit Beta-Thalassämie am Ende des Studienzeitraums keine Bluttransfusionen mehr beziehungsweise hatten Sichelzellpatienten auch keine Schmerzkrisen mehr."
Die Technologie habe das Potenzial, lebenslang zu wirken, hieß es vonseiten der britischen Zulassungsbehörde. Während der Untersuchungen seien keine wesentlichen Sicherheitsbedenken festgestellt worden. Die Sicherheit der Therapie werde von der Behörde genau überwacht. Bei der Mehrheit der Studienteilnehmer mit Sichelzellenanämie oder Beta-Thalassämie konnten die Symptome gelindert und die normale Produktion des roten Blutfarbstoffs wiederhergestellt werden.
Welche Nachteile hat der Eingriff? Welche Folgen sind möglich?
Selim Corbacioglu: "Anzumerken ist, dass der Nachbeobachtungszeitraum vergleichsweise kurz ist. Nebenwirkungen sind weiterhin denkbar. Wir wissen einfach noch nicht, ob die Patienten womöglich nach einigen Jahren plötzlich doch wieder Transfusionen benötigen oder Schmerzkrisen bekommen, weil die Zellen verschwunden sind." Es sei zu dem nicht zu 100 Prozent sicher, dass durch die Genschere nicht auch andere DNA-Abschnitte verändert werden.
"Die CRISPR-Therapie ist auch nicht ,mal eben‘ durchführbar. Der Therapie muss eine Chemotherapie mit all ihren bekannten Nebenwirkungen vorweg gehen. So verlieren die Patienten beispielsweise ihre Fruchtbarkeit", betont Corbacioglu. Die hochdosierte Chemotherapie ist notwendig, um die verbleibenden falschen Blutstammzellen abzutöten, und geht mit starken Nebenwirkungen einher. "Die wegen ihrer Häufigkeit beziehungsweise Bedrohlichkeit besonders hervorzuhebenden Spätfolgen sind eine anhaltende Unfruchtbarkeit und in seltenen Fällen auch die Entstehung von Krebserkrankungen", sagt Hämatologe Joachim Kunz vom Uniklinikum Heidelberg.
➤ Mehr lesen: Gen-Schere Crispr: Potenzial und ungelöste Probleme
Der Zeitpunkt der Therapie sei entscheidend, es dürfe etwa noch nicht zu Organschäden durch die Sichelzellenanämie gekommen sein.
Generell sei der Vorgang der Genschere "extrem komplex, erfordert eine aufwendige Logistik und wird absehbar aufgrund der benötigten Ressourcen nicht unbegrenzt skalierbar sein, sondern nur für eine begrenzte Zahl von Patienten pro Jahr zur Verfügung stehen", sagt Kunz.

Kommentare