Studien sollen Arzneien für Kinder sicherer machen
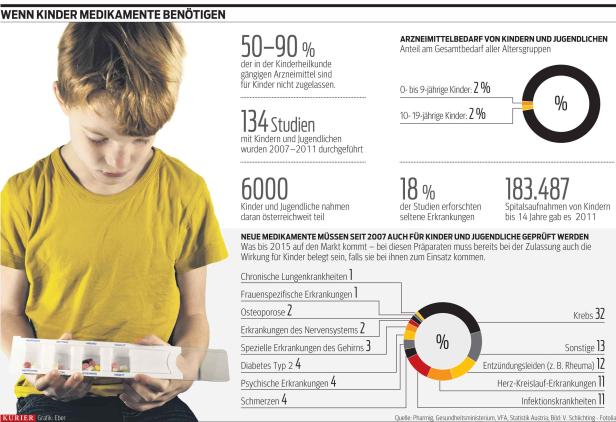
Sogar Fieberzäpfchen sind davon betroffen: „Es gibt keines, das für Kleinkinder vor dem 3. Lebensmonat zugelassen ist“, sagt Prim. Reinhold Kerbl, Präsident der Österr. Gesellschaft für Kinder- und Jugendheilkunde. „Trotzdem sind sie manchmal notwendig – dann müssen wir sie ohne Zulassung verabreichen.“ „Off-Label-Use“ heißt das – eine Anwendung ohne fundierte Dosierungs- und Anwendungsvorschriften für Kinder.
Bei einem Großteil der Arzneimittel, die für Kinder verwendet werden, ist dies der Fall: Sie wurden zugelassen, ohne ihre Wirkung bei Kindern und Jugendlichen zu belegen – erst seit 2007 ist dies für neue Präparate vorgeschrieben. Einfach die Erwachsenendosis auf das Kindergewicht umzurechnen funktioniert nicht: „Das kann zu Unter- und Überdosierungen führen“, betont die Kinder-Onkologin Univ.-Prof. Ruth Ladenstein.
Das soll sich jetzt ändern: Freitag startete das neue österreichische Forschungsnetzwerk für Kinderarzneimittel OKIDS. Das Gesundheitsministerium und 30 Mitglieder des Verbands der pharmazeutischen Industrie (Pharmig) finanzieren es gemeinsam mit 1,5 Mio. Euro für die nächsten fünf Jahre. Ziel ist, die Arzneimittelstudien mit Kindern und Jugendlichen in Österreich zu verdoppeln. „Die Verfügbarkeit von kindgerechten Arzneimitteln soll signifikant erhöht werden“, so Gesundheitsminister Alois Stöger.
„Lange hat man gesagt, Kinder sollen nicht in klinische Studien eingeschlossen werden“, erläutert Jan Oliver Huber, Generalsekretär der Pharmig. „Heute aber besteht europaweit Einigkeit, dass man Kinder – unter strengen Auflagen – in Studien einschließen soll.“
Mehr Nebenwirkungen
Der Grund: „Wir wissen heute, dass bei einem Off-Label-Einsatz die Zahl der Nebenwirkungen höher ist und von Studien letztlich alle profitieren“, sagt Ladenstein, neue OKIDS-Geschäftsführerin. Und es werden Kindern wichtige Therapien auch vorenthalten, weil ihre Anwendung ohne Studien zu riskant ist.
„Studien mit Kindern werden nur mit Medikamenten durchgeführt, die zuvor schon an Erwachsenen erprobt wurden. Es gibt extrem strenge Regeln für die Durchführung“, betont Ladenstein. Kinder werden erst nach umfassender Aufklärung und Zustimmung der Eltern in Studien aufgenommen. „Auch die Kinder werden ihrem Alter gemäß aufgeklärt und um ihre Einwilligung gefragt.“
Ohne Medikamentenstudien mit kleinen Patienten wäre es etwa nie möglich gewesen, den Prozentsatz der Kinder mit Krebs, die geheilt werden können, von 20 auf heute 80 Prozent zu erhöhen, sagt die Onkologin. Das Bild, dass Kinder in Studien Versuchskaninchen seien, sei falsch: „ Sie werden von einem Spezialistenteam intensiv betreut. Und ihre Heilungschancen sind besser.“
Kommentare