Embryomodelle: Neue Einblicke in die Entstehung menschlichen Lebens
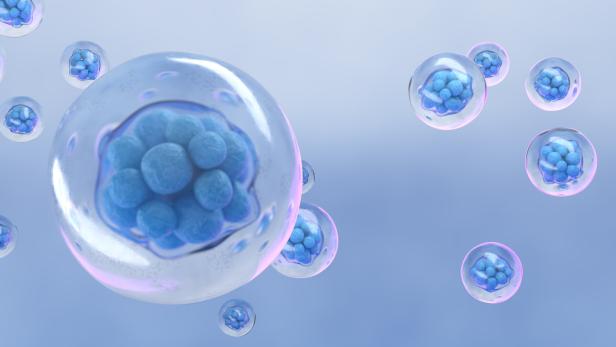
Früheste Entwicklungsphase eines Embryos: Mindestens die Hälfte aller Embryonen nistet sich nicht ein oder führt zu einer Fehlgeburt.
Welche Faktoren spielen bei der Entwicklung eines Embryos in seinen ersten Tagen eine Rolle? Gibt es bisher nicht bekannte Ursachen, die dafür verantwortlich sind, dass sich ein Embryo nicht in die Gebärmutter einnisten kann oder es zu einer Fehlgeburt kommt?
„Auf solche Fragen hatten wir bisher keine ausreichenden Antworten“, sagt Markus Hengstschläger, Leiter des Instituts für Medizinische Genetik an der MedUni Wien und stellvertretender Vorsitzender der Bioethikkommission: „Diese frühe Embryonalphase ist beim Menschen weitgehend unerforscht und bis zu einem gewissen Grad noch immer eine Blackbox.“ Der Grund: Forschung an Embryonen ist in Österreich - wie in den meisten Ländern - aus ethischen Gründen verboten.
Doch jetzt konnten Hengstschläger und seine Kollegin Margit Rosner neue Einblicke in diese Phase gewinnen. Möglich machte dies das Modell eines menschlichen Embryos aus Stammzellen, ein Embryoid (siehe Stichwort „Embryoid“). „Dieses Embryomodell entspricht dem Entwicklungsstand eines Embryos um Tag neun bis zehn. Es kann sich aber nicht zu einem Kind weiterentwickeln.“ Das Embryoid hat einen Durchmesser von in etwa 0,015 Zentimetern.
Um ein Embryoid bilden zu können, sind weder Ei- noch Samenzellen notwendig. Sie werden aus menschlichen Stammzellen gebildet, Vorläuferzellen, die sich noch in viele Zelltypen entwickeln können.
Durch die Anwendung bestimmter Kultivierungsbedingungen entwickeln sie sich in der Petrischale zu Zellgebilden, die Ähnlichkeiten mit einem Embryo in den ersten Entwicklungstagen haben. Sie können sich aber nicht in ein höheres Stadium weiterentwickeln.
„Es gibt weltweit nicht viele Labors, die das können“, sagt Hengstschläger.
Anhand solcher Modelle sei es erstmals überhaupt möglich, ethisch vertretbar und gesetzlich erlaubt, die Entstehung menschlichen Lebens zu studieren.
„Um die Tage 9 bis 10 nach der Befruchtung ist eine wichtige Entscheidung gefallen“, erläutert Hengstschläger: „Kann sich ein Embryo einnisten oder nicht?“ Man wisse heute, dass sich mindestens die Hälfte aller Embryonen entweder gar nicht einniste oder zu einer Fehlgeburt führe.

Genetiker Markus Hengstschläger von der MedUni Wien.
„Wir kennen dafür genetische Veränderungen des Embryos und mütterliche Faktoren – etwa immunologische Aspekte oder Gerinnungsstörungen – als Ursachen. Aber damit lassen sich wahrscheinlich nicht alle diese Fehlentwicklungen erklären“, betont Hengstschläger. „Es muss auch noch andere Gründe geben. Einer könnte sein, dass die Zellen des Embryos nicht richtig angeordnet sind und seine äußere Form verändert ist.“
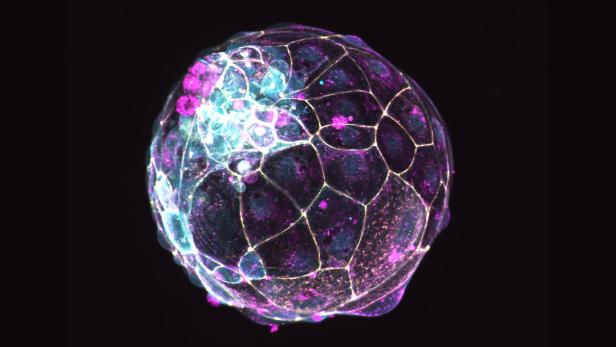
Mit den Embryomodellen konnte das Team um Hengstschläger den Ablauf dieser frühen Phase eines Embryos genau untersuchen: „Der Embryo ist von einer Membran umgeben, die ihn schützt, die zuständig für die richtige Anordnung seiner Zellen und für seine Form ist. Wir konnten erstmals nachweisen, dass der Embryo selbst einen relevanten Anteil an der Bildung dieser sogenannten Basalmembran hat. Das war bisher nicht so klar. Und wir konnten auch den Aufbau der Membran charakterisieren.“ Die Studie ist im bedeutendsten Fachmagazin für Entwicklungsbiologie, Developmental Cell, erschienen.
Warum diese Erkenntnisse wichtig sind? „Wir glauben, dass diese Membran für die Organisation des Embryos in den ersten Tagen zuständig ist. Kommt es zu Fehlentwicklungen der Membran, kann sich der Embryo eventuell nicht einnisten oder es kommt zu einer Fehlgeburt.“

Rosner und Hengstschläger konnten auch bereits ein Gen (Oct4) identifizieren, das eine wichtige Rolle bei der Ausbildung der Membran spielt: Ist es ausgeschalten (deaktiviert), können sich die Embryomodelle nicht entwickeln.
Das Team um Hengstschläger verfolgt drei Ziele: „Wir wollen neue Erkenntnisse gewinnen, wie menschliches Leben entsteht und welche Rolle im Detail dabei diese Membran spielt; darüber hinaus wollen wir genau verstehen, welche bisher nicht bekannten Gründe es gibt, wenn die Entwicklung nicht klappt.“
Und das dritte Ziel: Die Wirkungen und Nebenwirkungen von Medikamenten auf frühe Embryonen konnte bisher nur an Tieren untersucht werden. „Embryomodelle sind eine ethische Alternative.“
Im Vordergrund aber stehe das bessere Verständnis über die Entstehung des Lebens: „Da sind noch viele Fragen offen.“
Zur Person: Univ.Prof. Dr. Markus Hengstschläger ist Leiter des Instituts für Medizinische Genetik an der MedUniWien und stellvertretender Vorsitzender der Bioethikkommission.
Veranstaltungshinweis: Vom 13. bis 16. Juni organisiert Markus Hengstschläger in Lech das „Impact Lech Symposium“ (Anmeldungen unter www.impact-lech.at).
Kommentare