Corona-Vakzin: Wieso die Briten ab heute impfen, Österreich aber noch warten muss

Großbritannien ist eines der am stärksten von Corona betroffenen Länder in Europa: Bisher verzeichnete das Noch-Mitglied der Europäischen Union 77.000 Todesfälle. In der vergangenen Woche war Großbritannien aus diesem Grund vorgeprescht und hatte früher als alle anderen EU-Staaten einem Impfstoff die Freigabe per Notfallzulassung erteilt.
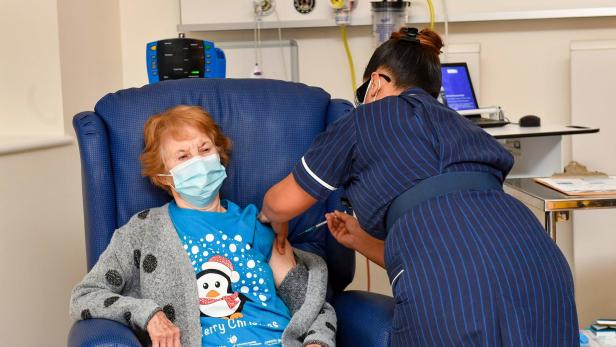
Heute, Dienstag, gingen dann die Bilder der 90-jährige Großmutter Margaret Keenan um die Welt, der KURIER berichtete: Sie erhielt um 7:31 Uhr den Impfstoff der Pharmaunternehmen Pfizer und BioNtech. Die Britin ist der erste Mensch, der außerhalb einer klinischen Studie den Wirkstoff bekam, der weltweit zu den vielversprechendsten Hoffnungsträgern zählt.
Laut einem britischen Regierungssprecher soll der Großteil der schutzbedürftigen Briten noch im Jänner und Februar geimpft werden. Auch in Russland und in China wird bereits mit Impfstoffen heimischer Hersteller geimpft.
Warum nicht auch in Österreich, fragen sich angesichts der heutigen Bilder viele Österreicher.
Europäische Union kennt keine Notfallzulassung
Tatsächlich verstoßen die Briten nicht gegen EU-Regeln, denen sie noch bis Jahresende unterworfen sind. Notfallzulassungen kennen alle EU-Mitgliedsstaaten, allerdings haben alle anderen darauf verzichtet. Herwig Kollaritsch, Infektionsexperte und Mitglied der Corona-Expertenkommission, erklärte in einem Ö1-Interview, dass Österreich nicht im Alleingang Schritte setzen wolle, weil man mit der Europäischen Union gemeinsam agieren wolle, schließlich erfolge auch die Beschaffung zentral über die EU.
Moralisch vertretbar angesichts der Todesopfer in Österreich? Kollaritsch: "Ich bin der Meinung, dass es hier nicht um Moral geht, sondern hier geht es einzig und allein um Arzneimittelsicherheit. Wenn wir einen Impfstoff zulassen würden, der nicht ausreichend geprüft ist, der zumindest nicht nach menschenmöglichen Überlegungen tatsächlich auch in der Bevölkerung breit eingesetzt werden kann, wenn wir damit ein Risiko eingehen, dann machen wir am Ende des Tages vielleicht mehr schlecht als gut. Und das soll vermieden werden. Wir wollen einen Impfstoff auf dem Markt haben, der breit einsetzbar ist, wo wir wissen, dass wir dem Menschen keinen Schaden zufügen, zumindest der menschlich abschätzbar gewesen wäre."
Anders als die Mitgliedsstaaten oder die USA kennt die EU das Instrument einer Notfallzulassung nicht: Allerdings kennt die Europäischen Arzneimittelagentur EMA die Möglichkeit einer sogenannten "konditionalen Zulassung". Bei dieser bedingten Zulassung ("Conditional marketing authorisation") kann die EMA ein Mittel unter bestimmten Voraussetzungen auch auf Grundlage weniger umfassender Daten zulassen, wenn das Präparat dringend gebraucht wird.
Nach dem US-Pharmakonzern Moderna hat auch die Mainzer Firma Biontech gemeinsam mit dem US-Pharmakonzern Pfizer die Zulassung für einen Corona-Impfstoff in der EU beantragt. Von der Europäische Arzneimittel-Agentur EMA wird die wichtige Entscheidung über eine Zulassung des Biontech/Pfizer-Impfstoffs noch in den nächsten Wochen erwartet.
Wann die EU-Kommission entscheiden wird
Bereits seit einigen Wochen begutachtet die EMA drei Coronavirus-Impfstoffe: jenen vom britisch-schwedischen Konzern AstraZeneca in Kooperation mit der Uni Oxford, vom Mainzer Unternehmen BioNTech und der US-Firma Pfizer sowie jenen Impfstoff von der US-Firma Moderna. In diesem "Rolling-Review-Prozess" werden wissenschaftliche Daten untersucht, bevor alle notwendigen Unterlagen für die Antragstellung zur Zulassung vorliegen.
Die EMA will im Dezember über eine Zulassungsempfehlung für den Corona-Impfstoff von Biontech/Pfizer entscheiden. Bis spätestens 29. Dezember soll ein Prüfungs-Ergebnis laut der Agentur mit Sitz in Amsterdam vorliegen. Zum Antrag des US-Konzerns Moderna auf Zulassung seines Impfstoffs werde eine Entscheidung bis zum 12. Januar erwartet.
Sollte die EMA zu den Anträgen grünes Licht geben, kann die EU-Kommission die Verwendung der Impfstoffe für alle Mitgliedsländer genehmigen. Die EU-Kommission hat sich bekanntlich je rund 400 Millionen Impfstoffdosen bei AstraZeneca sowie bei Pfizer/BioNTech gesichert, bei Moderna lautet der Vertrag auf 160 Millionen Dosen.


Kommentare