England erlaubt Gen-Forschung an Embryos
Für die BBC und andere britische Medien waren es „breaking news“: Großbritannien erlaubt einer Forschergruppe, das Erbgut menschlicher Embryonen zu verändern – und die Auswirkungen zu untersuchen. Die Embryonen werden von Paaren gespendet, die nach einer erfolgreichen künstlichen Befruchtung nicht alle ihre befruchteten (und noch tiefgefrorenen) Eizellen benötigen. Die genetischen Veränderungen dürfen nur zu Forschungszwecken durchgeführt werden – veränderte Embryonen dürfen auch keiner Frau in die Gebärmutter implantiert werden. Trotzdem ist der Vorstoß ethisch extrem umstritten.
Konkret gestattet die Behörde HFEA (Human Fertilisation and Embryology Authority) dem Londoner Francis Crick Institute eine Gen-Veränderung an Embryonen. Die dürfen aber nicht älter als sieben Tage sein. Dabei handelt es sich um ein Gen (Oct4), das eine wesentliche Rolle in der Frühentwicklung von Embryos spielt. Studienleiterin Kathy Niakan vom Francis Crick Institute will es ausschalten.
Entwicklung verstehen
„Wir wollen besser verstehen, welche Gene dafür notwendig sind, dass sich ein Embryo erfolgreich zu einem gesunden Baby entwickelt“, sagt Niakan. Dieses Wissen könnte dazu beitragen, Fehlgeburten zu verhindern und die Erfolgsraten bei künstlicher Befruchtung zu erhöhen.
Letztlich hofft man, mit dieser Technik aber auch Erbkrankheiten zu heilen, indem defekte durch gesunde Gene getauscht werden – für viele das eigentliche Ziel dieser Forschung.
Möglich wird das durch eine neuartige „Gen-Schere“, die vom Fachmagazin Science zum wissenschaftlichen Durchbruch des Jahres 2015 gewählt wurde. Damit können einzelne, z. B. defekte Gene gezielt aus dem Erbgut herausgelöst und durch andere (gesunde) Varianten ersetzt werden (siehe auch Grafik oben und Geschichte rechts).
Die Reaktionen von Experten sind geteilt: Befürworter erhoffen sich neue grundlegende Einblicke in die Embryo-Entwicklung, Kritiker warnen vor Designer-Babys, deren Erbsubstanz eines Tages nach den individuellen Wünschen der Eltern verändert werden könnte.
Keine Keimbahntherapie
Der österreichische Genetiker Univ.-Prof. Markus Hengstschläger lehnt eine „Keimbahntherapie“ ab – also Eingriffe ins Erbmaterial, die nach einer Implantation eines solchen Embryos in die Gebärmutter von Generation zu Generation weitergegeben werden: „Die langfristigen Folgen sind nicht absehbar.“ Das ist auch der Hauptkritikpunkt vieler anderer Experten: Diese Forschung öffne eine Tür, gezielt in die Keimbahn einzugreifen. „Dass solche Eingriffe nicht durchgeführt werden, war bisher internationaler Konsens. Die Briten wollen offenbar eine Vorreiterrolle einnehmeN“, sagt etwa der deutsche Experte Prof. Hans Schöler.
Hengstschläger erinnert daran, dass in vielen Ländern schon jetzt Forschung an Embryonen erlaubt sei: „Um embryonale Stammzellen zu gewinnen, mussten irgendwann einmal auch Embryos zerstört werden.“ Angesichts des aktuellen Falls stellt der Genetiker allerdings die Frage, ob die Erkenntnisse, die man aus dieser Studie gewinnen könne, „nicht auch zum Beispiel mit Mäuseembryos erzielt werden könnten“.
Große Skepsis
Der deutsche Experte Prof. Hans Schöler bewertet die Entwicklung mit Skepsis: „Diese Forschung hat eine neue Qualität. Sie öffnet eine Tür, gezielt in die Keimbahn eines menschlichen Embryos einzugreifen“, sagte der Leiter des Max-Planck-Instituts für molekulare Biomedizin in Münster der Deutschen Presse-Agentur. „Dass solche Eingriffe nicht durchgeführt werden, war bisher internationaler Konsens. Die Briten wollen offenbar eine Vorreiterrolle einnehmen.“
Letztlich, so glaubt der Experte, werde die Forschung darauf abzielen, Krankheiten zu vermeiden. Die Keimbahn betrifft jene Zellen, die sich später zu Keimzellen - also Spermien oder Eizellen - entwickeln.
Sehen Sie hier eine Info-Grafik zum Thema:
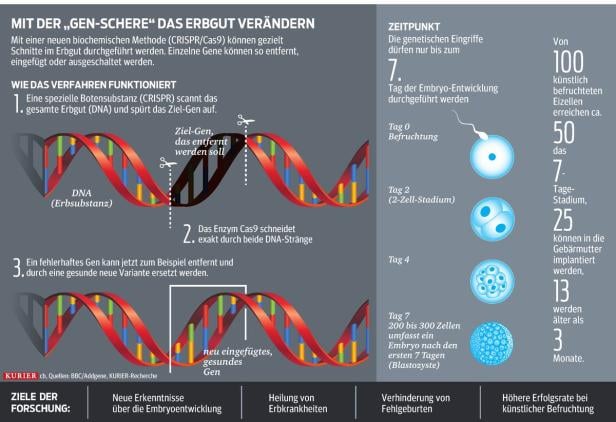
Was die Gen-Schere alles kann
Die neue, 2012 entdeckte "Gen-Schere" wird von vielen Genetikern – wie auch von Markus Hengstschläger von der MedUni Wien – "als einer der größten Durchbrüche in unserem Fach" bezeichnet. Vielfach war bereits im Vorjahr erwartet worden, dass die beiden Erfinderinnen, Emmanuelle Charpentier (Frankreich) und Jennifer Doudna (USA), dafür mit dem Nobelpreis ausgezeichnet werden.
Bei Mäusen konnten jedenfalls schon gezielt jene genetischen Veränderungen entfernt werden, die Auslöser einer unheilbaren Muskelschwund-Erkrankung sind.
Therapie von Augenleiden
Auch bei Menschen gibt es bereits Erfolge: US-Forscher haben mit der Gen-Schere eine spezielle Form einer Netzhaut-Erkrankung – ausgelöst durch einen einzigen genetischen Defekt – geheilt.
Und so funktionierte das: Die Genetiker nahmen Stammzellen der Patienten, schnitten das fehlerhafte Gen heraus, fügten ein gesundes ein und injizieren diese Zellen in die Augen der Patienten.
Sehleistung nahm zu
Die Folge: Gesunde Netzhautzellen bildeten sich, die Sehleistung der Patienten nahm wieder zu. "Solche Ansätze befürworte ich", sagt Genetiker Hengstschläger, "denn damit behebt man vor Ort im menschlichen Körper einen Organschaden. Diese Reparatur wird aber nicht an kommende Generationen weitergegeben."
Gen-Scheren-Erfinderin Charpentier hat übrigens einen starken Österreich-Bezug: Sie hat sieben Jahre an den Max F. Perutz Laboratories am Vienna Biocenter in Wien-Erdberg gearbeitet.
Kommentare