EMA lässt Proteinimpfstoff von Novavax in der EU zu
In der EU kommt eine weitere Covid-19-Schutzimpfung auf den Markt. Die Arzneimittelbehörde EMA gab am Montag grünes Licht für das Vakzin des US-Biotechunternehmens Novavax. Der zuständige EMA-Ausschuss empfahl eine bedingte Zulassung ab 18 Jahren. Nach der Empfehlung erteilte die EU-Kommission dem Impfstoff am Montag die bedingte Marktzulassung, wie EU-Kommissionspräsidentin Ursula von der Leyen mitteilte. Die Auslieferung soll im Jänner starten.
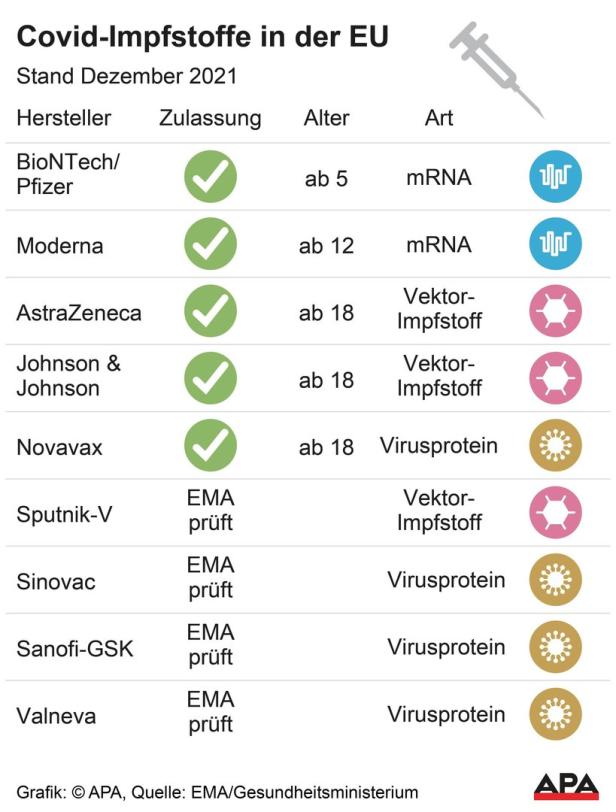
Bereits auf dem Markt sind die mRNA-Vakzine von Biontech/Pfizer und Moderna sowie die zwei Vektor-Impfstoffe von AstraZeneca und Johnson & Johnson (J&J). Letzterer war als letztes im März freigegeben worden. Bei Novavax hat sich die Staatengemeinschaft bis zu 200 Millionen Dosen gesichert.
Österreich hat beim Impfstoff "Nuvaxovid" des Herstellers Novavax für die erste bestellbare Tranche die maximalen Liefermengen abgerufen. "Dies entspricht rund 750.000 Dosen, deren Lieferungen nach letzten Informationen im ersten Quartal 2022 beginnen sollen (gleichzeitig mit den anderen EU-Staaten)", hieß es auf APA-Anfrage aus dem Gesundheitsministerium. "Danach werden weitere Optionen verfügbar sein."
Nach Ankunft in Österreich werde der neue Impfstoff über das Verteilungssystem des Bundes an die Impfstellen ausgeliefert. Ob das Vakzin frei wählbar ist, "wird von der Verfügbarkeit abhängig sein", wurde in der schriftlichen Stellungnahme betont. Dies liege im Ermessen der Bundesländer, die in Österreich für die Organisation und die Durchführung der Impfkampagne verantwortlich sind.
"Nicht warten"
"Mit Novavax erweitert künftig ein zusätzlicher Impfstoff das europäische Portfolio", zeigte sich Gesundheitsminister Wolfgang Mückstein (Grüne) erfreut. "Die EMA-Zulassung ist Garant für ein sicheres und umfassendes Prüfverfahren. Ich bitte Sie aber nicht auf diesen Impfstoff zu warten, sondern bereits jetzt das umfassende und kostenlose Impfangebot in Anspruch zu nehmen. Vor allem die Booster-Impfung schützt vor der neuen Omikron-Variante. Warten Sie nicht, gehen Sie noch vor den Feiertagen impfen", empfahl der Mediziner und Minister.
In der entscheidenden Phase-III-Studie mit rund 30.000 Teilnehmern hatte das Vakzin eine Gesamtwirksamkeit von rund 90 Prozent gezeigt. Doch die angestrebte Zulassung zog sich in die Länge, da Novavax mit Produktionsproblemen zu kämpfen hatte. In den Philippinen und Indonesien hatte der Impfstoff im November bereits eine Notfallzulassung erhalten. Bis Ende des Jahres ist auch der Zulassungsantrag für die USA geplant.
Ob sein Impfstoff auch vor der sich rasant ausbreitenden Omikron-Variante schützt, überprüft Novavax gegenwärtig in Labortests und rechnet mit Ergebnissen in den kommenden Wochen. Falls nötig, könnte mit der Herstellung eines angepassten Vakzins im Jänner begonnen werden, hatte das Unternehmen vor kurzem mitgeteilt. Die Daten aus der Zulassungsstudie, die in den USA und Mexiko stattfand, stammen aus einem Zeitraum, als die Alpha-Variante noch das Infektionsgeschehen beherrschte.
Virusähnliche Partikel verwendet
Nuvaxovid besteht laut Paul-Ehrlich-Institut (PEI) aus virusähnlichen Partikeln, die das Spike-Protein des Coronavirus enthalten. Die Proteine werden vom Körper als fremd erkannt und das Immunsystem wird hochgefahren - spezifische Antikörper und T-Zellen werden gebildet. Damit ist man vor einer echten Infektion besser gewappnet. mRNA-Präparate zum Beispiel funktionieren anders. Hier werden Körperzellen mit Hilfe von Erbgutschnipseln angeregt, selbst das Spike-Protein herzustellen, um eine Immunantwort auszulösen.
Konkret erfolgt die Produktion der Spike-Proteine bei Novavax so: Ungefährliche Viren werden gentechnisch so verändert, dass sie die Erbsubstanz für das Spike-Protein enthalten. Insektenzellen werden dann mit diesen Viren infiziert – und produzieren das Spike-Protein. Dieses wird aus den Zellen entnommen, gereinigt und schließlich verimpft.
Valneva: Zulassung unklar
Wann der Totimpfstoff von Valneva des österreichisch-französischen Biotechnologie-Unternehmens zugelassen wird, ist unklar. Das könnte noch mehrere Wochen wenn nicht gar Monate dauern. Traditionelle Totimpfstoffe stoßen vor allem bei Menschen auf Interesse, die Vorbehalte gegen eine Immunisierung mit mRNA-Vakzinen oder Vektorimpfstoffen haben.
Kommentare