Zweiter Zulassungsantrag: Impfstoff kommt jetzt in Riesenschritten

Nach dem US-Pharmakonzern Moderna hat nun auch die Mainzer Firma Biontech gemeinsam mit dem US-Pharmakonzern Pfizer die Zulassung für einen Corona-Impfstoff in der EU beantragt. Der Antrag auf eine bedingte Marktzulassung sei am Montag bei der Europäischen Arzneimittelagentur EMA in Amsterdam eingereicht worden, teilten Biontech und Pfizer am Dienstag mit.
Die EMA will noch im Dezember über eine Zulassungsempfehlung für den Corona-Impfstoff von Biontech/Pfizer entscheiden. Bis spätestens 29. Dezember soll ein Ergebnis der Prüfung vorliegen, teilte die Agentur am Dienstag in Amsterdam mit. Zum Antrag des US-Konzerns Moderna auf Zulassung seines Impfstoffs werde eine Entscheidung bis zum 12. Januar erwartet.
Biontech und Pfizer hatten bereits vor gut einer Woche eine Notfallzulassung bei der US-amerikanischen Lebensmittelüberwachungs- und Arzneimittelbehörde (FDA) beantragt. In den USA tagt das zuständige Gremium der FDA am 10. Dezember, dann könnte über die US-Notfallzulassung entschieden werden.
Ebenfalls gestern Montag hat auch der US-Pharmakonzern Moderna die Zulassung für einen Corona-Impfstoff in der EU beantragt - dieser Antrag wurde aber im Gegensatz zu jenem von Biontech/Pfizer schon gestern bekannt. Parallel dazu wurde auch eine Notfall-Zulassung bei der US-amerikanischen Arzneimittelbehörde FDA beantragt.
Sollte die EMA zu den Anträgen grünes Licht geben, kann die EU-Kommission die Verwendung der Impfstoffe für alle Mitgliedsländer genehmigen. Die Kommission folgt in der Regel der EMA-Empfehlung.
In Europa gibt es das Instrument einer Notfallzulassung nicht. "Wir haben aber die Möglichkeit einer ,konditionalen Zulassung`", sagt vor einiger Zeit der österreichische EMA-Chefmediziner Hans-Georg Eichler. Bei der bedingten Zulassung („Conditional marketing authorisation“) kann die EMA ein Mittel unter bestimmten Bedingungen auch auf Grundlage weniger umfassender Daten zulassen, wenn das Präparat dringend gebraucht wird:
"Das ist eine zeitlich begrenzte frühzeitige Zulassung unter genau definierten Auflagen. Im Gegensatz zu der Notfallzulassung in den USA gibt es hier aber eine ganz klare Voraussetzung: Der Nutzen der früheren Verfügbarkeit überwiegt das potenzielle Risiko der geringeren Informationsmenge. Wenn wir einen Impfstoff mit einer sehr guten Schutzwirkung haben, der sehr gut verträglich ist, dann kann auch eine relativ kleine Informationsbasis eine konditionale Zulassung rechtfertigen. Die Firma bekommt aber Auflagen, einen Zeitplan, welche Daten sie noch liefern muss", sagte Eichler.
Die Europäische Arzneimittelbehörde EMA begutachtet bereits seit einigen Wochen drei Coronavirus-Impfstoffe: vom britisch-schwedischen Konzern AstraZeneca in Kooperation mit der Uni Oxford, dem Mainzer Unternehmen BioNTech und der US-Firma Pfizer sowie von der US-Firma Moderna. In diesem „Rolling-Review-Prozess“ werden wissenschaftliche Daten untersucht, bevor alle notwendigen Unterlagen für die Antragstellung zur Zulassung vorliegen. Bis Ende Dezember soll jetzt das erste Gutachten zu BioNTech/Pfizer vorliegen.
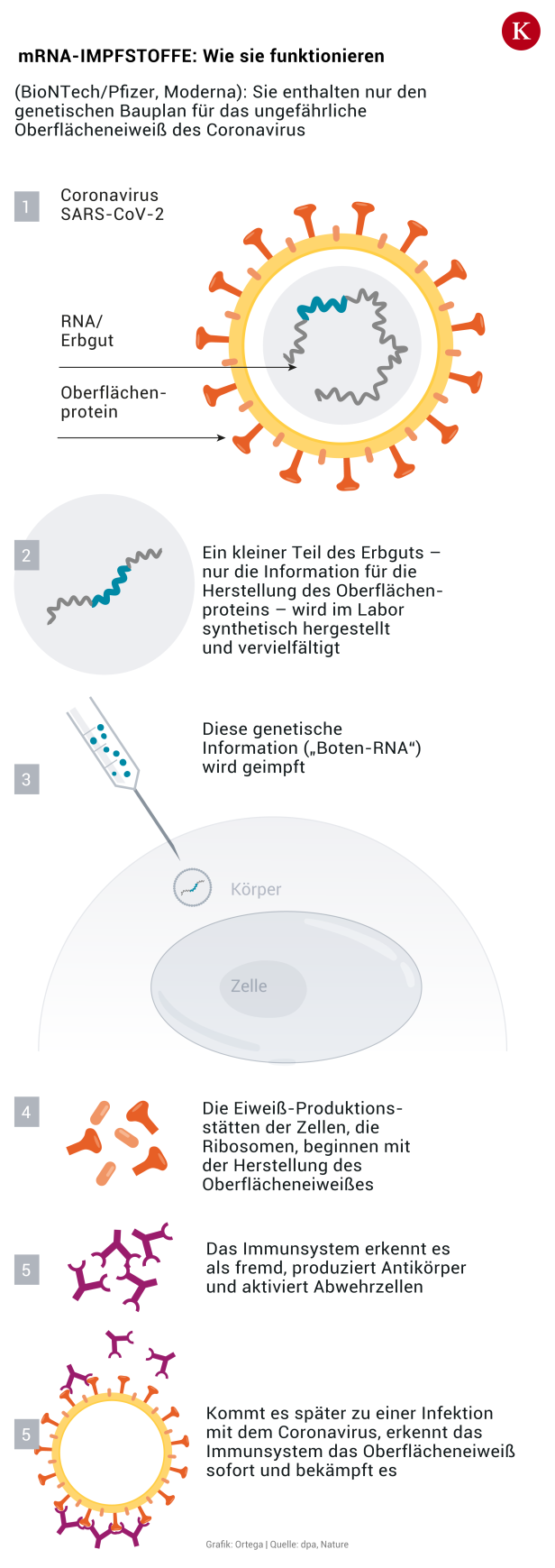
Die Technik hinter den Impfstoffen
Die Präparate von Pfizer und Biontech sind sogenannte RNA-Impfstoffe. Sie enthalten genetische Informationen des Erregers, aus denen der Körper dann ein Viruseiweiß herstellt. Ziel der Impfung ist es, das Immunsystem zur Bildung von Antikörpern anzuregen, um die Viren abzufangen. Noch gibt es keinen zugelassenen Impfstoff dieser Art.
Zwar haben schon Länder wie Russland, China und kürzlich erst Bahrain Impfstoffe mit Einschränkungen freigegeben und impfen damit bereits Teile der Bevölkerung. Aber wie gut diese Impfungen tatsächlich schützen und welche Nebenwirkungen sie haben können, ist derzeit weitgehend offen.
Impfungen ab Dezember?
EU-Kommissionspräsidentin Ursula von der Leyen sagte vor kurzem in einer Videokonferenz mit Bundeskanzler Sebastian Kurz, dass "wir wahrscheinlich schon im Dezember in Europa mit dem Impfen beginnen können." In Österreich sollen als erste in Alters- und Pflegeheimen Bewohner über 65 Jahren sowie die Mitarbeiter geimpft werden. In der ersten Phase liegt der Focus ebenso auf Pflege- und Gesundheitspersonal in Krankenanstalten, Ordinationen, Rettungsorganisationen und sozialen Diensten sowie auf Hochrisikogruppen mit definierten Vorerkrankungen.
"Im Idealfall kann im Jänner, Februar eine Million Dosen für den österreichischen Markt zur Verfügung stehen", sagte kürzlich Clemens Martin Auer, Covid-Sonderbeauftragter im Gesundheitsministerium. Bei zwei notwendigen Teilimpfungen pro Person wären damit 500.000 Menschen zu immunisieren. Er betonte jedoch, dass "nicht alles von heute auf morgen anders werden" könne, "im Jänner wird nicht alles möglich sein".
In Österreich stehen 200 Millionen Euro für den Ankauf von 18,5 Millionen Dosen von sechs Herstellern (Biontech/Pfizer, Moderna, Curevac, AstraZeneca, Johnson&Johnson, Sanofi) zur Verfügung. Pro Person sind zwei Impfdosen im Abstand von drei bis vier Wochen notwendig.
Die Impfstoffe werden alle zentral von der EU beschafft. Mit sechs der sieben Impfstoffanbieter wurden bereits fixe Vorverkaufsverträge auf EU-Ebene abgeschlossen. 70 Prozent dieser Impfstoffe werden laut Gesundheitsministerium in Europa produziert.

Kommentare