Wie sicher sind Medikamententests?
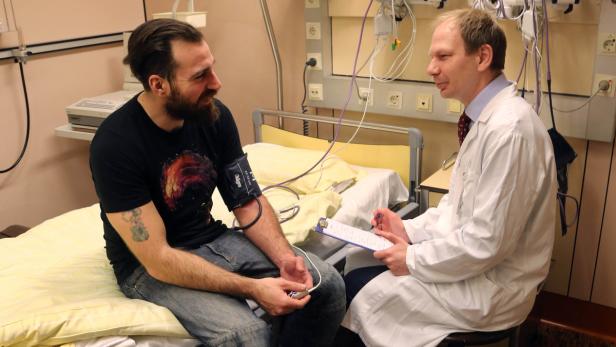
"30 Studien waren es in den vergangenen 16 Jahren mindestens, so genau weiß ich es nicht mehr." Matthias Trinkl, 36, ist Donnerstagfrüh zur Kontrolle auf der Klinik für Klinische Pharmakologie der MedUni Wien/AKH Wien. Er kommt oft ins Spital, obwohl er völlig gesund ist – als Proband (Teilnehmer an Studien), nicht als Patient. Im Dezember nahm er an einer "First-in-Man"-Studie teil – der erstmaligen Testung eines neuen Wirkstoffes am Menschen – so, wie das auch in Frankreich gemacht wurde (siehe unten). Er erhielt eine Infusion mit einem Antikörper, der bei einer lebensbedrohlichen Infektion mit dem Bakterium Staphylococcus aureus die Giftstoffe des Bakteriums bekämpfen soll.
Als Student sei natürlich die finanzielle Aufwandsentschädigung ein wesentlicher Grund gewesen, mitzumachen, sagt Trinkl. "Mittlerweile sind für mich die vielen ärztlichen Kontrollen eine starke Motivation: Dabei wurde schon das eine oder andere entdeckt, das überhaupt nichts mit den Studien zu tun hatte. Keiner meiner Freunde kennt zum Beispiel seine Blutwerte so gut wie ich. Ich habe viel über meinen Körper gelernt – und auch über die Bedeutung der medizinischen Forschung."
Kaum Nebenwirkungen
Nebenwirkungen hatte er bis auf einen Fall nie verspürt – auch in den Laborwerten gab es nie Auffälligkeiten: "Einmal hatte ich eine Stunde lang grippeähnliche Symptome wie Schüttelfrost. Aber das wusste man vorab."

Wer entschädigt wird
Gesunde Teilnehmer werden nur in dieser ersten Studienphase, in der es ausschließlich um die Sicherheit eines Wirkstoffes geht, eingesetzt. Und nur sie erhalten eine Aufwandsentschädigung. Patienten, die ja auch einen gesundheitlichen Nutzen von einem neuen Wirkstoff haben könnten, werden nicht entschädigt. Bei Krebsmedikamenten, die viele Nebenwirkungen haben können, werden auch in Phase I nur Patienten eingeschlossen.
Zeitlinger: "Der Katalog der Entschädigungshöhen wird von unserer Ethikkommission festgelegt. Die Summen sind so bemessen, dass sie einerseits zum Beispiel für Studenten ein gewisser Anreiz sind – aber sie sind nicht hoch genug, dass sich jemand in einer sozialen Notlage damit retten kann."
Wie hoch die Entschädigung ist
Pro Stunde im AKH bekommen Probanden eine Vergütung in der Höhe von acht Euro, müssen sie im Bett liegen, kommen drei Euro dazu. Für eine Vor- oder Nachuntersuchung bekommen sie je 20 Euro, für eine Blutabnahme sechs Euro und ein EKG vier Euro. – Zeitlinger: "Wir kämpfen darum, in Österreich möglichst viele Studien – auch Phase I – durchführen zu können. Bei uns ist die Sicherheit der Patienten deutlich größer als in vielen Staaten der Welt."
Lesen Sie hier ein Interview mit Priv.-Doz. Markus Zeitlinger, interimistischer Leiter der Uni-Klinik für Klinische Pharmakologie der MedUni Wien.

KURIER: Was antworten Sie, wenn jemand behauptet, Patienten in solchen Studien seien Versuchskaninchen?
Markus Zeitlinger: Dass es nicht stimmt. Beim Versuchskaninchen nimmt man einen Schaden an einem Organ bewusst in Kauf, um Nebenwirkungen einer Substanz herauszufinden. Beim Menschen tun wir alles, um einen Schaden zu verhindern. Trotzdem ist das Risiko der Medikamentenentwicklung nicht gleich null. Aber wir tun wirklich alles, um es so stark wie möglich zu reduzieren.
Wie können Sie das erreichen?
Die Richtlinien in
Österreich sind sehr streng. Vor jedem Test am Menschen gibt es umfangreiche Tierversuche. Eine Ehtikkommission und eine staatliche Behörde müssen die Studie – mit strengen Auflagen – genehmigen. Jene Dosis, die im Tierversuch keine Nebenwirkungen gezeigt hat, wird vor dem ersten Einsatz beim Menschen um das Zehn- bis Hundertfache reduziert, manchmal sogar um das Fünfhundertfache. Sechs Personen bekommen dann hintereinander nur ein einziges Mal diese Dosis, zwei ein Placebo. Sie werden für mindestens eine Nacht bei uns aufgenommen, damit wir beim geringsten Problem sofort reagieren können.

Und wie geht es dann weiter?
Nach der ersten Dosis warten wir zirka zwei Wochen – bis wir sicher sein können, dass mit keinen Nebenwirkungen mehr zu rechnen ist. Dann bekommt die nächste Gruppe von acht Personen den Wirkstoff bzw. ein Placebo – in einer etwas höheren Dosierung. Mit jeweils acht neuen Probanden wird die Dosis dann so weit gesteigert, bis jene Menge erreicht ist, bei der man mit der erhofften Wirkung der Substanz rechnet. Ist auch hier nichts auffällig, beginnen wir bei wiederum neuen Probanden mit sehr niedrigen Dosierungen über mehrere Tage hinweg.
Und wenn doch eine unerwartete
Nebenwirkung auftritt?
Wenn diese schwer ist, würde die Studie sofort gestoppt werden und die Nebenwirkung durch Prüfarzt, Behörden und Ethikkommission genau analysiert werden. Mit dem Vorfall in Frankreich vergleichbare Nebenwirkungen hatten wir in Österreich aber noch nie.
Können Sie sich erklären, wie es in
Frankreich zu dem Zwischenfall gekommen ist?
In Frankreich wurde eine Substanz getestet, die verhindern soll, dass körpereigene, schmerzunterdrückende Stoffe abgebaut werden – eigentlich ein schonender Ansatz. Die schweren, das Gehirn beeinträchtigenden Nebenwirkungen (bei sechs Probanden, einer davon starb, Anm.) sind offenbar in der Phase aufgetreten, in der Probanden bereits mehrere Dosen hintereinander erhalten haben. Bei uns sind die Probanden auch im Falle von wiederholten Gaben entweder durchgehend stationär betreut oder extrem engmaschig überwacht.
Könnte man auf Studien auch verzichten?
Nein, ohne sie gäbe es keinen medizinischen Fortschritt. Und viele alte Medikamente, die starke Nebenwirkungen haben, aber vor 30 Jahren noch nicht so genau geprüft wurden, würden heute keine Zulassung mehr bekommen.
Zahlen und Fakten
Situation in Österreich:
Europaweit werden derzeit 8000 klinische Studien durchgeführt, in Österreich sind es 500 mit mehr als 6000 Teilnehmern. Phase-I- Studien zur Überprüfung der Sicherheit von Substanzen gibt es in Österreich jährlich ungefähr 35 bis 40.
Bessere Therapiechancen:
Patienten in Studien haben Vorteile durch die vielen medizinischen Kontrollen – auch dann, wenn sie nur ein Placebo (Präparat ohne Wirkung) erhalten. Auch Gesunde profitieren von den Durchuntersuchungen.
Kommentare